약학부 김용기 교수팀, 미토콘드리아 항상성과 세포노화 조절의 핵심 메커니즘 규명
- 조회수 1106
- 작성자 커뮤니케이션팀
- 보도일자 2024-09-10
 (왼쪽부터) 숙명여대 약학부 김용기 교수, 석박통합과정 조예나 학생.
(왼쪽부터) 숙명여대 약학부 김용기 교수, 석박통합과정 조예나 학생.
약학부 김용기 교수 연구팀이 미토콘드리아와 활성산소종 생성 사이의 악순환을 연결하는 핵심 분자의 조절 메커니즘을 밝혀냈다.
이번 연구는 핵 내에 있는 단백질 아르기닌 메틸화 효소 CARM1(Coactivator-associated arginine methyltransferase 1)이 세포질로 이동하는 과정을 규명한 것이다.
연구팀에 따르면 활성산소종은 p38감마(γ)를 활성화해 CARM1을 인산화하고, 이를 통해 세포질로의 이동을 촉진한다. 세포질로 이동한 CARM1은 다이나민 관련 단백질1(DRP1)을 메틸화해 미토콘드리아 분절을 촉진한다.
이 과정에서 발생한 활성산소종은 다시 p38γ를 활성화하는 순환 루프를 형성한다. 결과적으로 세포노화와 암 발생을 일으키는 산화적 스트레스의 세포 내 축적 메커니즘을 이번 연구를 통해 밝혀낸 것이다.
앞서 김용기 교수 연구팀은 지난 7월 발표한 논문에서 CARM1이 미토콘드리아와 활성산소종 사이의 악순환 고리를 연결하는 핵심 분자 표적이라는 사실을 증명한 바 있다.
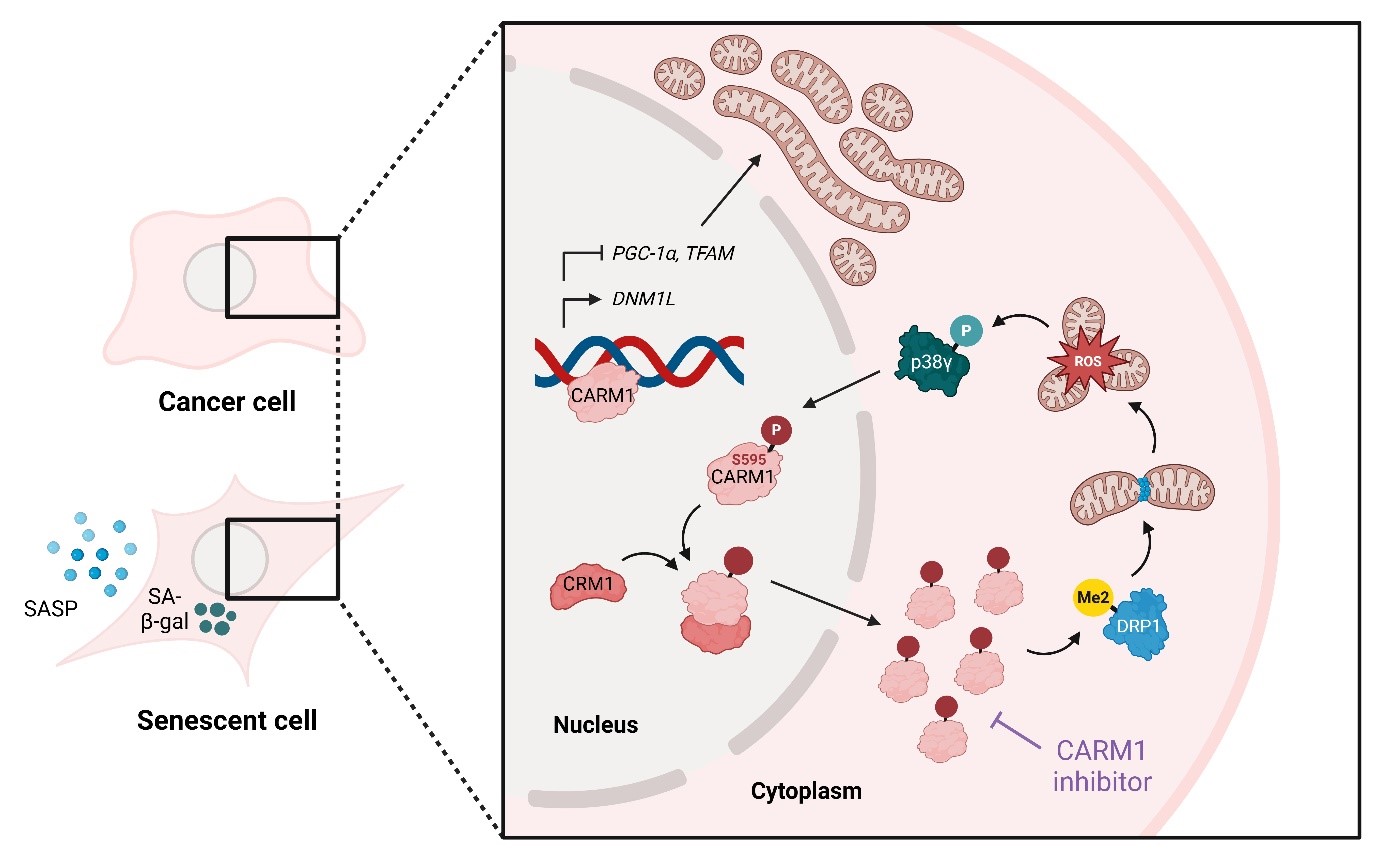 CARM1의 세포질 이동은 활성산소종 생성을 가속화하여 세포노화를 유도한다.
CARM1의 세포질 이동은 활성산소종 생성을 가속화하여 세포노화를 유도한다.
이번 연구는 활성산소종에 의한 CARM1의 세부 조절 메커니즘을 추가적으로 규명함으로써 건강한 노화를 위한 새로운 전략적 표적으로 CARM1을 제시했다는 점에서 큰 의의가 있다.
연구 성과는 9월 6일 생화학·분자생물학 분야의 세계적 학술지 리독스 바이올로지(Redox Biology)(IF 10.7, JCR 5.4%)에 온라인으로 발표됐고, 2024년 10월호에 정식 게재될 예정이다. 논문명: CARM1 phosphorylation at S595 by p38γ MAPK drives ROS-mediated cellular senescence(CARM1은 p38γ MAPK에 의해 595번 세린 잔기가 인산화되어 활성산소종에 의한 세포노화를 매개한다)
약학과 석박통합과정 조예나 학생이 제1저자, 김용기 교수가 교신저자로 참여한 이번 연구는 한국연구재단 선도연구센터(MRC) 사업과 기초연구사업(중견연구) 지원을 받았다.
연구진은 "이번 성과를 바탕으로 고령화 사회의 핵심 과제인 건강한 노화를 위해 CARM1의 후속 연구와 그 선택적 저해제 개발에 집중할 예정"이라고 밝혔다.

